已知下列两个反应:反应Ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H1反应Ⅱ:CO2(g)+H2O(g)⇌C
反应Ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H1
反应Ⅱ:CO2(g)+H2O(g)⇌CO2(g)+H2(g)△H2
(1)相同温度下,若上述反应I的化学平衡常数为K1,反应Ⅱ的化学平衡常数为K2,那么K1•K2=______.
(2)反应Ⅰ的化学平衡常数墨和温度t的关系如表一所示:
表一:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
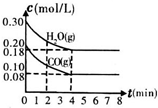
(3)如果上述反应Ⅰ以CO和H2O(g)为起始反应物,在T℃时CO和H2O(g)的浓度变化如图所示,且密闭容器的容积为1L0,那么0~4min的平均反应速率v(CO)=______mol(L•min),对照“表一”可知T=______℃.
(4)某温度下,反应I的化学平衡常数为2.25.在该温度下,向甲、乙、丙三个恒容密闭容器中通入CO2 (g)和H2(g),这两种物质的起始浓度如表二所示:
表二:
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
共回答了177个问题采纳率:87.5%
(2)依据图表数据分析,平衡常数随温度升高增大,平衡正向进行,反应是吸热反应;
(3)分析图象得到一氧化碳的变化浓度,结合化学反应速率概念计算得到一氧化碳的反应速率,计算平衡浓度得到平衡常数,对比表中平衡常数得到温度;
(4)丙中的二氧化碳和氢气的浓度都最大.而反应温度相同,故丙中反应速率最大;甲、丙为等效平衡,而乙中二氧化碳的浓度大于氢气的浓度,所以乙中氢气的转化率最大,依据化学平衡来计算平衡浓度得到平衡常数和氢气的转化率.
(1)反应Ⅰ和反应Ⅱ是温度相同条件下方向相反的反应,反应的平衡常数互为倒数,则K1•K2=1,故答案为:1;
(2)由表格中温度与化学平衡常数的关系可知,温度越高,平衡常数越大,即升高温度平衡正向进行,正反应是吸热反应,△H1>0,故答案为:>;
(3)图象分析可知一氧化碳的反应速率v(CO)=[0.20mol/L−0.08mol/L/4min]=0.03mol/L•min;
化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算的平衡常数,和图表数据比较得到温度;图表分析得到数据,平衡时,c(CO)=0.08mol/L;c(H2O)=0.18mol/L,c(CO2)=0.12mol/L;c(H2)=0.12mol/L;平衡常数K=[0.18×0.08/0.12×0.12]=1.0,对比图表可知温度为850℃;
故答案为:0.03;850;
(4)丙中的二氧化碳和氢气的浓度都最大.而反应温度相同,故丙中反应速率最大;甲、丙为等效平衡,而乙中二氧化碳的浓度大于氢气的浓度,所以乙中氢气的转化率最大,设丙中平衡时一氧化碳的浓度为xmol/L,二氧化碳浓度为(0.02-x)mol/L,氢气的浓度为(0.02-x)mol/L,水的浓度为xmol/L,平衡常数K=
x2
(0.02−x)2=2.25,计算得到x=0.012mol/L,即氢气的浓度为0.008mol/L,丙中氢气的转化率=[0.02−0.008/0.02]×100%=60%,
故答案为:丙;乙;60%.
点评:
本题考点: 化学平衡常数的含义;物质的量或浓度随时间的变化曲线;化学平衡的计算.
考点点评: 本题考查了化学平衡的分析判断,平衡计算方法的应用,平衡常数,转化率概念的计算分析,掌握基础是解题关键,题目难度中等.
-
已知函数f(x)=sin( - x)coswx+cos已知函数f(x)=sin(pai-wx)coswx+cos平方wx
2024-05-031个回答
-
已知函数f(x)=2cos x sin(x+pai/6)-sin^2x+cos^2x.
2024-05-032个回答
-
已知函数Y=2sin^X+2sinXcosX-5cos^X 已知函数Y=2sin^X+2sinXcosX-5cos^X,
2024-05-031个回答
-
已知函数f(x)=x2+(sinα-2cosα)x+1是偶函数 则sinαcosα=
2024-05-034个回答
-
sin cos三角函数题解已知α为锐角 sinα=3cosα 求sinαcosα
2024-05-032个回答
-
刚学完三角函数,1.已知COS∝/(1+SIN∝)=A,SIN∝/(1+COS∝)=B,A-B=k(COS∝-SIN∝)
2024-05-031个回答
-
would you please tell me _ a.what to do b.how to do it c.whe
2024-05-034个回答
-
英语!英语!Please tell me_____next.A how to do B what to do it C
2024-05-037个回答
-
what will you do if you are asleep?please tell me the way to
2024-05-036个回答
-
Please tell me____to improve my English. 为什么填what to do
2024-05-035个回答
-
Would you please tell me what to do next? do 为及物动词后跟宾语,为什么wh
2024-05-032个回答
-
would you please tell me()next A how to do B what to do C wh
2024-05-031个回答
-
Could you tell me ___ to do next,please?填what还是how?
2024-05-033个回答
-
Would you please tell me __ next?A.how to do B.what to do C.
2024-05-032个回答
-
what do you want me to tell your mother Please tell her .abo
2024-05-034个回答
-
Please tell me____to improve my English.为什么填what to do
2024-05-031个回答
-
Please tell me__next?A how to do Bwhat to do C to do what D
2024-05-033个回答
-
Would you please tell me what to do it 对吗,how to do 后面可以接it吗
2024-05-031个回答
-
Please tell me what to do是一个完整的句子吗?what to do是作宾语吗
2024-05-034个回答
-
两种单质点燃生成化合物的表达式两种不同元素的原子.这两种元素分别组成的单质
2024-05-034个回答
你能帮帮他们吗
-
2024-05-063个回答
-
一个数的因数一定( )样它的倍数 A.大于 B.等于 C.小于或等于
2024-05-064个回答
-
2024-05-062个回答
-
2024-05-064个回答
-
2024-05-062个回答
精彩回答
-
光滑水平面上静止放着长L=2m,质量为M=3kg的木板,一个质量为m=1kg的小物体放在木板的最右端,m和M之间的动摩擦
2024-05-024个回答
-
2024-05-023个回答
-
很简单的一道不等式,突然纠结看这个方程式:X/(X-2) < 0A 直接等价于 X(X-2)<0 且X≠2B 分成两种情
2024-05-023个回答
-
3个0,7个1,排成一排,要求0不能相邻,求排列数.题目很短的,也应该很简单.但是答案写的没看懂,数字是我自己给的,关键
2024-05-023个回答
-
2024-05-022个回答
