(2010•潮州二模)一定温度下可逆反应:A(s)+2B(g)═C(g)+D(g)△H<0.
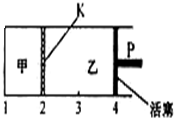 (2010•潮州二模)一定温度下可逆反应:A(s)+2B(g)═C(g)+D(g)△H<0.现将1mol A和2molB加入甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使甲的容积为1L,乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
(2010•潮州二模)一定温度下可逆反应:A(s)+2B(g)═C(g)+D(g)△H<0.现将1mol A和2molB加入甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使甲的容积为1L,乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )A.保持温度和活塞位置不变,向甲中再加入1 mol A和2mol B,达到新的平衡后,c(B)甲=2c(B)乙
B.保持温度和乙中体积不变,再向乙中加入2 mol D,达到新平衡后,c(B)乙≤2c(B)甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
共回答了88个问题采纳率:89.5%
从等效平衡的角度分析,乙中加入2molC和2molD相当于开始加入2molA和4molB,乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,甲、乙容器内对应物质的浓度相同,各组分的含量相同,
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,则相当于在原来的基础上增大压强,A是固体,反应前后气体体积不变,平衡不移动,反应物的转化率不变,达到平衡时,甲中C的浓度等于原来的2倍,即等于乙中C的浓度的2倍,即c(B)甲=2c(B)乙,故A正确;
B.保持温度和乙中体积不变,向乙中再加入2 mol D,D的浓度增大,平衡向逆反应方向移动,达到新平衡后,乙中B的浓度比原平衡状态浓度增大,即c(B)乙>c(B)甲,故B错误;
C.甲、乙两容器平衡常数相同,平衡时两容器内对应各物质的浓度相同,
对于甲容器:A(s)+2B(g)⇌C(g)+D(g)
开始(mol):1 2 0 0
变化(mol):x2x x x
平衡(mol):1-x 2-2x xx
反应前后气体体积不发生变化,用物质的量代替浓度代入平衡常数计算,则:[x×x
(2−2x)3=1,解得x=
2/3],所以甲中B的转化率为
2mol×
2
3
2mol=66.7%;
平衡时,甲容器中C的物质的量为[2/3]mol,平衡时两容器内对应各物质的浓度相同,故乙容器内C的物质的量为[4/3]mol,所以乙容器内C的转化率为
2mol−
4
3mol
2mol=33.3%,故C错误;
D.该反应正反应为放热反应,升高温度,平衡向逆反应进行,B的物质的量增大,混合气体总的物质的量不变,故达到新的平衡后,甲、乙中B的体积分数均增大,故D正确.
故选:AD.
点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡移动的影响因素、等效平衡、平衡计算等,难度中等,注意从等效平衡的角度分析起始时甲乙两容器内的气体的平衡状态,在此基础上从平衡移动的角度分析,C选项可以形成规律,等效平衡从正逆反应建立平衡,转化率之和为1.
-
2024-04-251个回答
-
利用微粒知识解释下列现象用温度计计量体温时,水银柱上升,是因为:在很远的地方可以闻到花的香味,是因为:可以将大量的氧气压
2024-04-251个回答
-
一天小明的妈妈从市场买了2KG苹果 回来时 小明非要让妈妈抱着 妈妈一手提着苹果 一手抱着小明 看妈妈辛苦 小明说:妈妈
2024-04-251个回答
-
已知月球上无大气、无磁场、弱重力,下列关于“中华牌月球车”的设计设想部正确的是
2024-04-251个回答
-
用水银温度计测液体温度,温度计示数上升过程中,水银的质量《不变》密度《减小》,是不?
2024-04-253个回答
-
小明的妈妈早上出去买菜时看了一下表,时针与分针恰好在7:00—8:00之间重合,回来时又看了一下表,时针与分针恰好在8:
2024-04-254个回答
-
15℃的空气中,声音的传播速度是 ______m/s.人在岸边走过时,会吓跑水中的鱼,说明 ______,月球上“死寂无
2024-04-251个回答
-
(2011•丽水)我国的“嫦娥工程”将按“绕月、落月和驻月”三步进行,计划2012年实验落月探测,已知月球上无大气、无磁
2024-04-251个回答
-
在月球上,宇航员之间近在咫尺,却只能用无线电通话,说明了声音______传播.
2024-04-251个回答
-
月球上既无空气,也无磁场,同一物体在月球所受的引力是地球的1/6.假如你登上了月球,你可以做下列的哪件事( ) A.用
2024-04-251个回答
-
地震时震源的震动以横波和纵波,两种波的速度为34km/s和56km/s,两种波到达震中时间差为2S,震源到震中距离
2024-04-253个回答
-
假如月球上发生了火山爆发,地球上的我们听不到声音,但月球上的宇航员可以听到声音.
2024-04-251个回答
-
2024-04-251个回答
-
2024-04-251个回答
-
2024-04-251个回答
-
地震时震源的振动以横波和纵波两种形式向外传播,两种波在地壳中的传播速度并不一样,分别约为34km/s和56km/s.震源
2024-04-255个回答
-
2024-04-254个回答
-
地震时横波速度7.5km/s,纵波14km/s,人们先感到纵波,隔10s又感到横波,求人与震源的距离
2024-04-251个回答
-
地震时,地震波从震源中心同时向各个方向传播出纵波和横波.纵波的传播速度是4千米/秒,横波的传播速度是2.6千米/秒.
2024-04-251个回答
-
地震的速度是多少汶川地震时北京也有震感,灯在晃,高楼也在晃,时间大约是14时36分左右.震波的速度是多少呢?
2024-04-251个回答
你能帮帮他们吗
-
2024-04-253个回答
-
一道初三关于圆的几何证明~~~P是两圆公共弦的延长线上任意一点,自P向两圆分别作切线PA和PB,求证:PA=PB可以根据
2024-04-251个回答
-
英文句子分析,is前半句具体到句子各个成分,用了什么特殊的句式吗?
2024-04-251个回答
-
英文句子句式suffer not yourselves to be betrayed with a kiss这是什么句式
2024-04-251个回答
-
2024-04-251个回答
精彩回答
-
甲乙丙三人分一筐苹果,甲的苹果是乙的二分之一,丙分得的是乙的2倍,甲乙各分了多少
2024-04-253个回答
-
..,甲乙丙三人分桃子,甲是乙丙之和的三分之一,乙是甲丙之和的二分之一,已知丙分了5000斤,问甲乙各分了多少斤?
2024-04-252个回答
-
2024-04-253个回答
-
2024-04-252个回答
-
赵州桥体现了劳动人民的智慧和才干,是我国宝贵的历史遗产。修改病句
2024-04-255个回答
